«ADHS ist komplex. Es gibt keine Schwarz-Weiss-Antworten.»
ADHS – die Aufmerksamkeitsdefizit-Hyperaktivitätsstörung – betrifft weltweit rund fünf Prozent der Kinder und Jugendlichen. Es ist die häufigste psychiatrische Erkrankung in dieser Altersgruppe. Erwachsene sind ebenfalls betroffen. Ob in der Schule, bei der Arbeit oder im privaten Rahmen: Viele Betroffene leiden unter ihrer Erkrankung. Sie können nicht längere Zeit stillsitzen, sich nur schlecht konzentrieren oder ecken mit ihrer Impulsivität an. Menschen mit ADHS haben Mühe, ihr Potenzial zu entfalten – trotz oft hoher Intelligenz. Doch die Potenzialentfaltung ist gerade in jungen Jahren entscheidend für eine gesunde persönliche Entwicklung. Gelingt sie nicht, drohen Rückschläge: Misserfolg, Frust, Mobbing oder auch Depressionen.
Verzögerte Entwicklung der Nervenzellen
Ursache ist eine Störung der frühen neuronalen Entwicklung, die durch ein komplexes Zusammenspiel von genetischen Veranlagungen und Umwelteinflüssen entsteht. Speziell jenes System, das im Gehirn für das Selbstmanagement zuständig ist, entwickelt sich bei ADHS nur verzögert. Deshalb sind bei Betroffenen diese Hirnareale – etwa die sogenannten Basalganglien – weniger aktiv im Vergleich zu Personen ohne ADHS. In dieser Hirnregion wirkt Dopamin, ein wichtiger Neurotransmitter, der vielen als Glückshormon bekannt ist.
Edna Grünblatt, Titularprofessorin an der Universität Zürich (UZH), forscht seit vielen Jahren zu ADHS. Die Wissenschaftlerin leitet zusammen mit Susanne Walitza, Ordentliche Professorin und Direktorin der Kinder- und Jugendpsychiatrie und Psychotherapie der UZH, den Forschungsbereich Translationale Molekulare Psychiatrie. Grünblatt weiss: «ADHS ist komplex, das Spektrum an Formen und Ausprägungen ist breit. Es gibt deshalb keine Schwarz-Weiss-Antworten.»
Ritalin wirkt paradox
Bei einer ADHS-Diagnose ist das Medikament Ritalin häufig die Therapie der Wahl. Dessen Wirkungsweise ist allerdings paradox: Der Wirkstoff Methylphenidat gehört zu den Psychostimulanzien, die normalerweise anregend wirken. Man würde erwarten, dass behandelte Patient:innen damit aktiver sind. «Bei ADHS passiert aber genau das Gegenteil: Betroffene werden ruhiger, sind fokussierter», betont Grünblatt. Methylphenidat erhöht die Aktivität der Nervenzellen in den Basalganglien in etwa auf das Niveau von Personen ohne ADHS. Funktioniert das Selbstmanagement im Gehirn wieder, ändert sich auch das Verhalten.
Ein anderes Bild zeigt sich, wenn Menschen ohne ADHS Ritalin einnehmen. Bei ihnen hören die Nervenzellen in den Basalganglien auf, aktiv zu sein, vergleichbar wie bei unbehandelten ADHS-Patient:innen. In diesen Fällen stimuliert das Medikament die Neuronen im Gehirn, die Personen werden unruhiger, hyperaktiver. Bei ADHS wirkt Methylphenidat somit anders. Fragt sich nur: warum?
Früher vermuteten die Forschenden, dass Methylphenidat die Dopamintransporter blockiert. Dadurch gibt es mehr Dopamin in den Synapsen, den Kontaktstellen der Nervenzellen. Die These wurde mit Knock-out-Mäusen getestet, d.h. Tieren, denen die Dopaminrezeptoren fehlen. Diese Mäuse sind auffallend hyperaktiv. Überraschenderweise wurden auch sie ruhiger, wenn sie Methylphenidat erhielten. Doch wie kann das Medikament wirken, wenn die Andockstellen für Dopamin komplett fehlen?
Zentraler Signalweg weist Richtung
Die Substanz muss also anders wirken – und genau hier setzt Edna Grünblatts Forschung an. Zu Beginn nutzte sie Krebszellen von Tieren und Menschen. Als sie diesen Zellkulturen Methylphenidat hinzufügte, verlangsamte sich deren Teilung. Statt sich weiter zu vermehren, begannen die Zellen, sich zu differenzieren und zu Nervenzellen zu entwickeln. Dasselbe geschah auch bei embryonalen Stammzellen von Mäusen und Ratten. Der Effekt liess sich also nicht auf Krebszellen-spezifische Eigenschaften zurückführen.
Das brachte die Forschenden auf eine neue Spur: einen zentralen Signalweg im Körper, der Zellteilung und -entwicklung reguliert, bekannt unter dem Namen «Wnt». Grünblatt und ihr Team konnten zeigen, dass Methylphenidat tatsächlich den Wnt-Signalweg aktiviert. Was die Wissenschaftler:innen zur nächsten Frage führte: Wirkt Methylphenidat über diesen Mechanismus auch auf die Nervenzellen von Patient:innen?
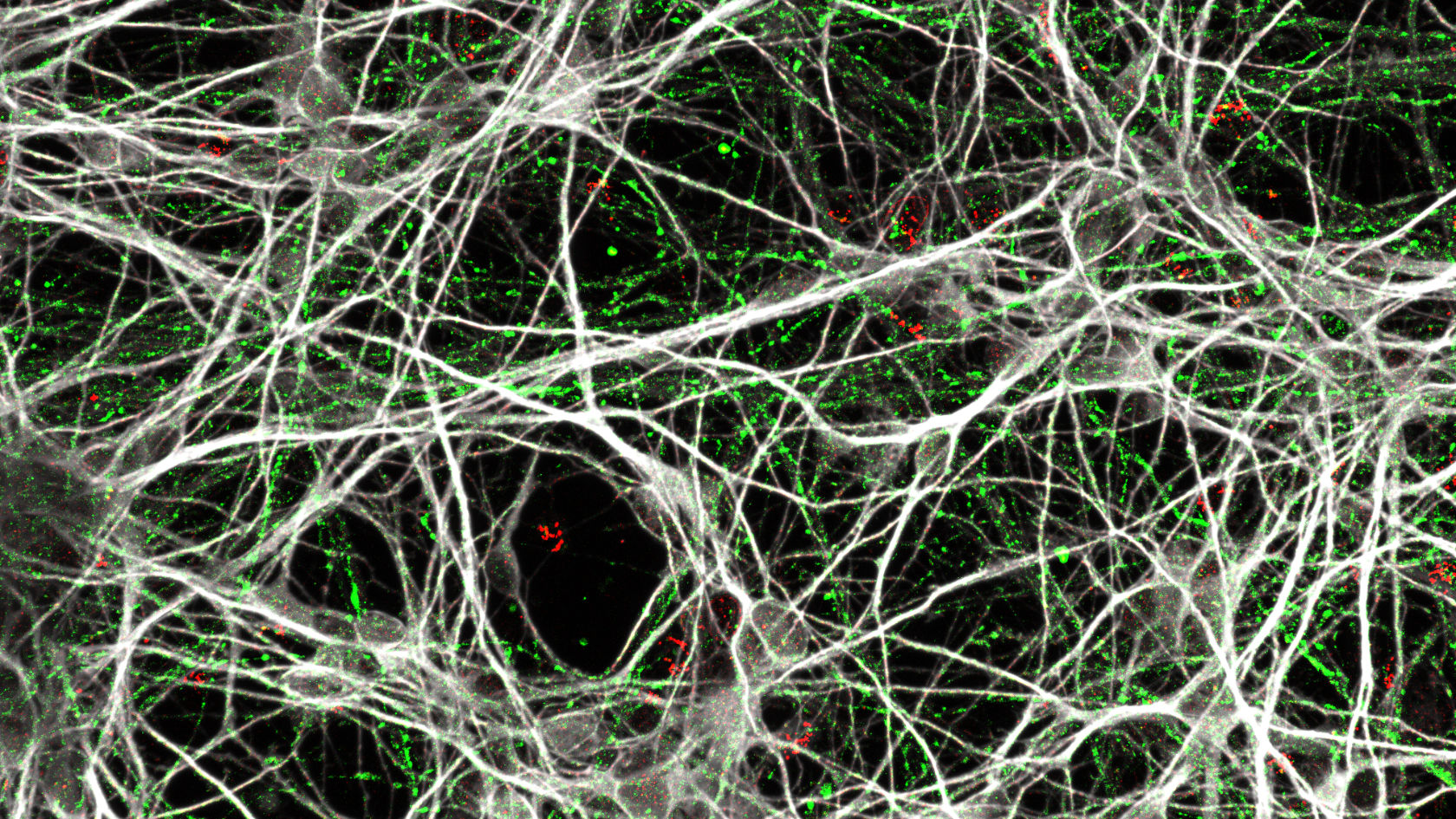
Eine entscheidende Entwicklung in der Forschung öffnete Grünblatt dabei neue Türen: induzierte pluripotente Stammzellen (engl. abgekürzt: iPSC). Diese lassen sich im Labor herstellen, indem normale Körperzellen mithilfe von nur vier Genen in einen embryonalen Zustand zurückversetzt werden. Aus diesen Stammzellen können wiederum unterschiedliche Nervenzelltypen gezüchtet werden.
Von der Klinik ins Labor – und zurück
«Translationale Forschung zu betreiben, steht bei uns im Mittelpunkt. Wir wollen auf molekularer und zellulärer Ebene verstehen, was wir in der Klinik sehen», sagt Grünblatt. Die Untersuchungen mehrerer iPSC von ADHS-Patient:innen stellten das Forschungsteam erneut vor ein Rätsel: Der Wnt-Signalweg ist bei ADHS bereits bei den Vorläuferzellen der Neuronen aktiver. «Wenn wir zu ADHS-Zellen in der Petrischale Methylphenidat geben, wird die Wnt-Aktivität sogar noch verstärkt im Vergleich zu gesunden Nervenzellen», so die Expertin.
Tatsächlich wachsen Nervenzellen bei ADHS in den iPSC-Modellen langsamer. Wird Methylphenidat verabreicht, beschleunigt bzw. normalisiert sich ihre Teilung – offenbar, weil der Wnt-Signalweg aktiviert wird. Blockieren die Forschenden diesen und geben dann den Wirkstoff hinzu, bleibt der Effekt aus. Methylphenidat wirkt also wahrscheinlich indirekt über Wnt. Untersucht wurde auch die Wirkung von Omega-3-Fettsäuren, da diese in einigen klinischen Studien ebenfalls positive Effekte zeigten. Und tatsächlich fand das Forschungsteam auch in den ADHS-iPSC eine positive Wirkung auf das Nervenzellwachstum.
Frühe Entwicklung dank Stammzellen verfolgen
«Auch wenn wir bisher nur relativ einfache 2D-Modelle bestehend aus vier, fünf verschiedenen Zelltypen verwenden, die längst nicht an die Komplexität des Gehirns heranreichen, können wir bereits viel daraus lernen. Denn die iPSC tragen exakt das Erbgut unserer Patient:innen – bei komplexen Krankheiten wie ADHS ist das sehr wichtig», betont Edna Grünblatt. So lässt sich die Entwicklung der Nervenzellen von Anfang über längere Zeit verfolgen, etwas, das am Menschen oder beim Embryo kaum möglich wäre.
Für ihre bisherigen Messungen nutzte Grünblatts Team iPSC von fünf ADHS-Patient:innen und fünf Kontrollpersonen ohne ADHS. Hinzu kamen je vier weitere Zelllinien. Die kleine Fallzahl liegt vor allem an den hohen Kosten, denn Herstellung und Handling sind komplex. Nichtsdestotrotz haben sich induzierte pluripotente Stammzellen, die aus Patientenzellen gewonnen werden, inzwischen als Modell in der biomedizinischen Forschung breit etabliert.
Aktuell befinden sich Grünblatt und ihr Team in einer translationalen Phase: Sie konnten bereits Hinweise auf weitere molekulare Signalwege identifizieren, die bei ADHS verändert sind, wie beispielweise bestimmte Entzündungswege und oxidativer Stress. «Langfristig hoffen wir, durch unsere Forschung Risikofaktoren für die Neuroentwicklung bei Personen mit ADHS besser zu verstehen – und möglicherweise Ansätze zur frühzeitigen Prävention zu entwickeln», sagt die Forscherin.
Auch Tierversuche sind notwendig
Neben Zellkulturen werden in der ADHS-Forschung auch Versuchstiere eingesetzt. Grünblatt arbeitet mit zwei Forschungsteams in den Niederlanden und in Kroatien zusammen, die mit Tieren zu ADHS forschen. Im Vordergrund stehen Verhaltensmessungen. Die Versuche entsprechen den niedrigsten Belastungsgraden, den Schweregraden null oder eins.
Der Vorteil der Forschung mit Tieren ist, dass die Komplexität des gesamten Organismus erfasst werden kann. Denn das Gehirn steht in ständigem Austausch mit dem Körper – mit Hormonen, dem Immunsystem, dem Mikrobiom im Darm. Auch Faktoren wie Stress und Ernährung spielen eine Rolle. Jedes Modell, jede Methode liefert dabei einen Teil des grossen Puzzles.
Tierversuche bleiben trotz aller technischen Fortschritte unerlässlich – insbesondere bei komplexen Erkrankungen wie ADHS. Die moderne Forschung mit Tieren basiert auf den 3R-Prinzipien: reduzieren, verfeinern, ersetzen. Doch viele Fragen zu ADHS lassen sich nur im lebenden Organismus klären, etwa Kognition und Verhalten. Ob ein Tier hyperaktiv oder impulsiv ist, lässt sich gut untersuchen. In Zellkulturen, selbst in komplexeren Organoiden, ist das schlicht nicht möglich.